Большинство веществ, в зависимости от условий (темература, давление) могут находится в трех агрегатных состояниях. Все твердые вещества можно разделить на аморфные и кристаллические. Каждое вещество имеет четкую структуру атомов, которые образуют определенную геометрическую структуру, называемую кристаллическая решетка. Но при этом у каждого такого вещества типы кристаллических решеток будут разными.
- Кристаллическое и аморфное вещество
- Ионные кристаллы
- Атомные кристаллы
- Молекулярные кристаллы
- Семь типов кристаллических решеток
- Кубическая (или изометрическая) решетка
- Квадратичная (или тетрагональная) решетка
- Орторомбическая кристаллическая решетка
- Моноклинная решетка
- Триклинная решетка
- Ромбоэдрическая решетка
- Гексагональная кристаллическая решетка
Кристаллическое и аморфное вещество
Кристаллическое вещество: твердое вещество, у которого атомы или молекулы образуют правильную упорядоченную решетку. Большинство твердых веществ существует в кристаллическом состоянии, которое отличается повышенной стабильностью, но это не означает, что они имеют кристаллы в прямом смысле этого слова; например, чистая медь является кристаллической только потому, что ее атомы расположены в регулярном порядке.
Аморфное вещество: твердое вещество, не имеющее кристаллической структуры. Его атомы и молекулы расположены без соблюдения регулярности. Переохлажденные жидкости, такие как стекло, резина и некоторые пластмассы, являются аморфными.


Сейчас мы будем рассматривать только кристаллические вещества.
В зависимости от того, из каких частицы построена кристаллическая решетка и каков характер химической связи между ними, выделяют различные типы кристаллов. Выделяют 4 типа кристаллических решеток (КР): Молекулярная, ионная, металлическая и атомная.
Типы кристаллических решеток
| Тип кристаллической решетки | Частицы в узлах решетки | Характеристики | Вещества | тип связи |
| Молекулярная | Молекулы | Не прочный, низкая Тпл(температура плавления), летучие | Благородные газы: Ne, Ar … Галогены: F2, Cl2 Галогеноводороды: HF, HCl … Простые вещества неметаллы: О2, Н2, N2, P(белый) Оксиды и водородные соединения неметаллов: SO2, CO2, NH3, PH3 | Ковалентная (полярная и неполярная) |
| Ионная | Ионы | Прочная, Высокая Тпл, Нелетучие, Расплавы и растворы проводят эл.ток | Соли, оксиды и гидроксиды металлов | Ионная |
| Металлическая | Атомы и ионы | Пластичные Электро- и теплопроводные | Металлы и сплавы | Металлическая |
| Атомная | Атомы | Очень прочная, Очень высокие Тпл | С (алмаз, графит), Si ,Ge, B, SiO2(кремнезем, кварц) Al2O3 CaC2, SiC (карборунд), BN, Fe3C, P черный и красные | Ковалентная |
Ионные кристаллы
Ионные кристаллы образованы катионами и анионами (например, соли и гидроксиды большинства металлов). В них между частицами имеется ионная связь. Ионные кристаллы могут состоять из одноатомных ионов. Так построены кристаллы хлорида натрия, иодида калия, фторида кальция.
В ионном кристалле невозможно выделить одиночные молекулы. Каждый катион притягивается к каждому аниону и отталкивается от других катионов.
Атомные кристаллы
Атомные кристаллы состоят из отдельных атомов, объединенных ковалентными связями. Из простых веществ только бор и элементы IVA-группы имеют такие кристаллические решетки. Нередко соединения неметаллов друг с другом (например, диоксид кремния) также образуют атомные кристаллы. Они очень прочные и твердые, плохо проводят теплоту и электричество.
Молекулярные кристаллы
Молекулярные кристаллы построены из отдельных молекул, внутри которых атомы соединены ковалентными связями. Между молекулами действуют более слабые межмолекулярные силы. Они легко разрушаются, поэтому молекулярные кристаллы имеют низкие температуры плавления, малую твердость, высокую летучесть.
Для металлов характерна металлическая кристаллическая решетка. В ней имеется металлическая связь между атомами. В металлических кристаллах ядра атомов расположены таким образом, чтобы их упаковка была как можно более плотной. Связь в таких кристаллах является делокализованной и распространяется на весь кристалл.
Семь типов кристаллических решеток
Есть семь разных кристаллических систем. Они были обнаружены в 1781 году отцом Рене Джаст Хауи. Он случайно заметил, что некоторые камни имеют идеальную форму. После многих лет исследований он разработал свою теорию о структуре кристаллов. В 1848 году Огюст Браве показывает, что может быть только семь типов элементарной кристаллической сетки.
Системы характеризуют различные геометрические формы, которые может иметь кристаллическая сетка.
Каждая из этих систем определяется своими осями: три размерных параметра (длина осей) и три угловых параметра (углы, образованные двумя осями). Условно мы называем abc длинами осей и α β и γ углами, образованными осями. Они размещены в пространстве следующим образом:
![]()
Каждая ячейка, представляющая систему, также имеет определенное количество симметрий. Эти симметрии бывают трех типов:
- центральный (отмечен С): точка является центром симметрии сетки;
- плоскости (отмечено P): плоскость является плоскостью симметрии сетки;
- осевой (О): поворот на определенный угол вокруг оси симметрии возвращает сетку в положение, идентичное исходному.
Эти симметрии имеют четыре порядка:
- двоичные ( обозначено L 2 ): вращение на 180 ° (π рад)
- троичное (обозначено L 3 ): вращение на 120 ° (2π/3 рад)
- четвертичное (отмечено L 4 ): Вращение на 90 ° (π/2 рад.)
- гексагональное (отмечено L 6 ): вращение на 60 ° (π/3 рад.)
Кубическая (или изометрическая) решетка
| a = b = c: три оси имеют одинаковую длину α = β = γ= 90 °: три угла равны и прямые Симметрии: C, 3 L 4 , 4 L 3, 6L 2, 9 P Базовый элемент — это куб. |
Квадратичная (или тетрагональная) решетка
| a = b ≠ c: две оси имеют одинаковую длину, а третья ось различается. α = β = γ= 90 °: три угла равны и прямые Симметрии: C, L 4 , 4L2, 5 P Основным элементом является правая призма с квадратным основанием. |
Орторомбическая кристаллическая решетка
| a ≠ b ≠ c: три оси имеют разную длину α = β = γ= 90 °: три угла равны и прямые Симметрии: C, 3 L 2, 3 P Основной элемент — прямоугольный параллелепипед. |
Моноклинная решетка
| a≠b≠c : три оси имеют неравную длину. β = γ= 90 °≠α: два угла равны и прямые. Симметрии: C, L 2 , P Основным элементом является наклонная призма, в основании которой ромб. |
Триклинная решетка
| a≠b≠c: три оси имеют неравную длину. α≠β ≠ γ≠ 90 °: три угла разные. Симметрии: C, L 2 , P Основной элемент — это параллелепипед с основанием ромб. |
Ромбоэдрическая решетка
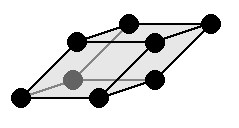 | a = b = c: три оси имеют одинаковую длину α = β = γ≠ 90 °: три угла равны и прямые Симметрии: C, L 3 , 3 L 2 , P Основным элементом является параллелепипед все плоскости которого — ромбы. |
Гексагональная кристаллическая решетка
| a = b ≠ c: две оси имеют одинаковую длину, не равную длине третьей оси α = β = 90° и γ=1200: три угла равны и прямые Симметрии: C, L 6 , 6 L 2 , 7 P Базовым элементом является призма с шестиугольным основанием. |
Таким образом, мы с вами рассмотрели подробно понятие кристаллическая решетка и то, какими бывают основные кристаллические решетки.