Строение электронных оболочек
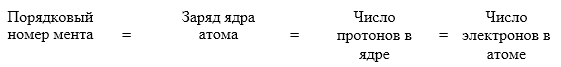 Массовое число равно сумме числа протонов и нейтронов в ядре.
Массовое число равно сумме числа протонов и нейтронов в ядре.Атомы одного элемента, которые имеют разные массовые числа, называются изотопами. (Изотопы содержат одинаковое число протонов, но разное число нейтронов)
Электронная оболочка — это совокупность всех электронов в данном атоме.
Орбиталь — часть атомного пространства, в которой вероятность нахождения электрона наибольшая.
Энергетический уровень — совокупность орбиталей, которые имеют одинаковое значение главного квантового числа.
Для примера, рассмотрим строение электронной оболочки элемента бора:

Как выглядит электронная оболочка в пространстве:
Строение атома:
- атом состоит из ядра и электронной оболочки;
- ядра атомов заряжены положительно, они состоят из протонов p+ и нейтронов no (вместе носят название нуклоны);
- при образовании положительно заряженного иона количество электронов уменьшается (на величину заряда данного иона), а при образовании отрицательно заряженного иона количество электронов увеличивается (на величину заряда данного иона).
Орбитали различаются по форме и энергии. Каждая орбиталь обозначается цифрой и лат.буквой. Цифра указывает энергию (энергетический уровень, т. е на сколько далеко орбиталь находится от ядра), а буква ― форму орбитали.
Формы орбиталей:
d и f ― более сложной формы.
![]()
![]()
Одинаковые по форме и энергии орбитали объединяются в подуровни. s подуровень состоит из одной s орбитали, p подуровень — из трех р орбиталей, d подуровень из 5 d орбиталей.
На каждой орбитали может находится не более двух электронов. Поэтому максимальное число электронов на s-подуровне ―2. на р ― 6, на d ― 10.
Подуровень | Количествоорбиталей | Макс. количество электронов | ||||||
s | s | 1*2=2 | ||||||
p | p | p | p | 3*2=6 | ||||
d | d | d | d | d | d | 5*2=10 | ||
f | f | f | f | f | f | f | f | 7*2=14 |
Электронная конфигурация криптона (последнего элемента 4 периода) записывается следующим образом: 1s22s22p63s23p64s23d104p6.
При заполнения электронных оболочек в первую очередь заполняются более низкие, ближайшие к ядру уровни и подуровни (от 1s орбтатали и далее) ― принцип минимума энергии. Порядок заполнения подуровней нужно запомнить!
![]()
Суммарная энергия всех электронов атома должна быть минимальной. Если это так, то такое состояние атома называется основным или невозбужденным. Это устойчивое состояние атома. Любое другое состояние атома называется возбужденным.